BLOG DE INVESTIGACIÓN MÉDICA
METABOLITOS INTERMEDIARIOS DEL CICLO DE KREBS
DETALLES DEL ESTUDIO
Título: Tricarboxylic cycle intermediates in combination with calcium phosphate chelators and sodium bicarbonate increase eGFR in patients with stages 3b, 4 and 5 CKD: a retrospective observational study [ver Ref. 1].
Año de publicación: 2024
Revista: Revista Colombiana de Nefrología
Tipo de estudio: observacional retrospectivo
Patrocinado por: Virtus Humanitatis
Número de pacientes: 55
Periodo de evaluación: en promedio 11 meses
Criterios de inclusión: ERC 3b, 4 o 5; mayores de 18 años.
Criterios de exclusión: pacientes con tratamiento sustitutivo renal y/o que estuvieran tomando alfa cetoanálogos y/o pre/probióticos.
Características de los pacientes:
-
Edad promedio: 67.2 años (mínima de 31 años y máxima de 88 años)
-
27 mujeres y 28 hombres
-
Etiología de la IRC:
69% DM2 | 23.6% HAS | 7% LES | 5.6% otras glomerulopatías
-
Distribución por estadios:
52.7% estadio 5 (TFGe <15m ml/min) | 36.4% estadio 4 (TFGe 15-30 ml/min) | 10.9% estadio 3b (TFGe 30-45 ml/min)
-
TFGe inicial promedio: 16.73 ml/min/1.73m2 (estadio 4)
RESULTADOS
Respecto a la TFGe, el valor inicial promedio previo a la administración de la formulación de los metabolitos intermediarios del Ciclo de Krebs fue de 16.73 ml/min y el final, a los 11 meses de seguimiento, fue de 19.18 ml/min, es decir, una mejoría, un aumento en la TFGe de 2.45 ml/min, al término de casi un año. Este resultado era esperado pues 69% de los pacientes reportaron un descenso en los niveles de creatinina por solo 31% con incremento de la misma. Respecto a la creatinina, esta disminuyó de valor inicial promedio de 4.26 mg/dl a 3.77 mg/dl con una diferencia anual a la baja de 0.49 mg/dl. Mención especial merece el hecho de que la disminución de la creatinina se presentó principalmente en los pacientes en estadio 5 con una reducción promedio de 0.92 mg/dl (cercano a 1).
Además de los beneficios en aumentar la TFGe y la disminución de la CR. Sérica, resultados nunca antes reportados en la literatura mundial, otros beneficios no menos importantes de la administración de los metabolitos intermediarios del Ciclo de Krebs fueron:
1.- Disminución de urea con valor basal promedio de 136.9 mg/dl y final de 113 mg/dl.
2.- Disminución del fósforo con valor inicial promedio de 5.04 mg/dl y final de 3.87 mg/dl. Con lo que 8 de cada 10 pacientes no necesitaron quelantes de fósforo adicionales.
3.- Aumento de la hemoglobina sérica con valor basal promedio de 11.16 gr y final de 11.68 gr, condición que permitió en algunos pacientes suspender de manera intermitente la administración de eritropoyetinas.
4.- Mantenimiento de un estado de normo-albuminemia pese a dietas hipoproteicas y el estado inflamatorio crónico característico de la IRC.
5.- Control de la acidosis metabólica crónica por su contenido de bicarbonato de sodio. 30 gramos de la formulación (2 porciones de 15 gramos) aportan 1.95 gramos de bicarbonato de sodio al día. Al respecto, el estudio de de Brito, "Suplementación de bicarbonato de sodio retarda la progresión de la ERC y mejora el estado nutricional", utiliza una dosis promedio diaria de 1.82 +/- 0.8 gramos [ver Ref. 2]. Nota: no se midió el bicarbonato sérico en el presente estudio.
Previo a este estudio clínico se realizó otro estudio abierto, observacional y retrospectivo en 20 pacientes con ERC estadios 3b, 4 y 5 que recibieron tratamiento con la misma formulación de metabolitos intermediarios del Ciclo de Krebs con un seguimiento mínimo de un mes y máximo de 5.5 años y edad promedio de 61.2 años. Los resultados del estudio fueron respecto a la urea, valor inicial promedio de 148.5 mg/dl y final de 106.17 mg/dl y por lo que toca al fósforo, valor inicial promedio de 6.7 mg/dl y final de 4.7 mg/dl [ver Ref. 3].
MECANISMO DE ACCIÓN
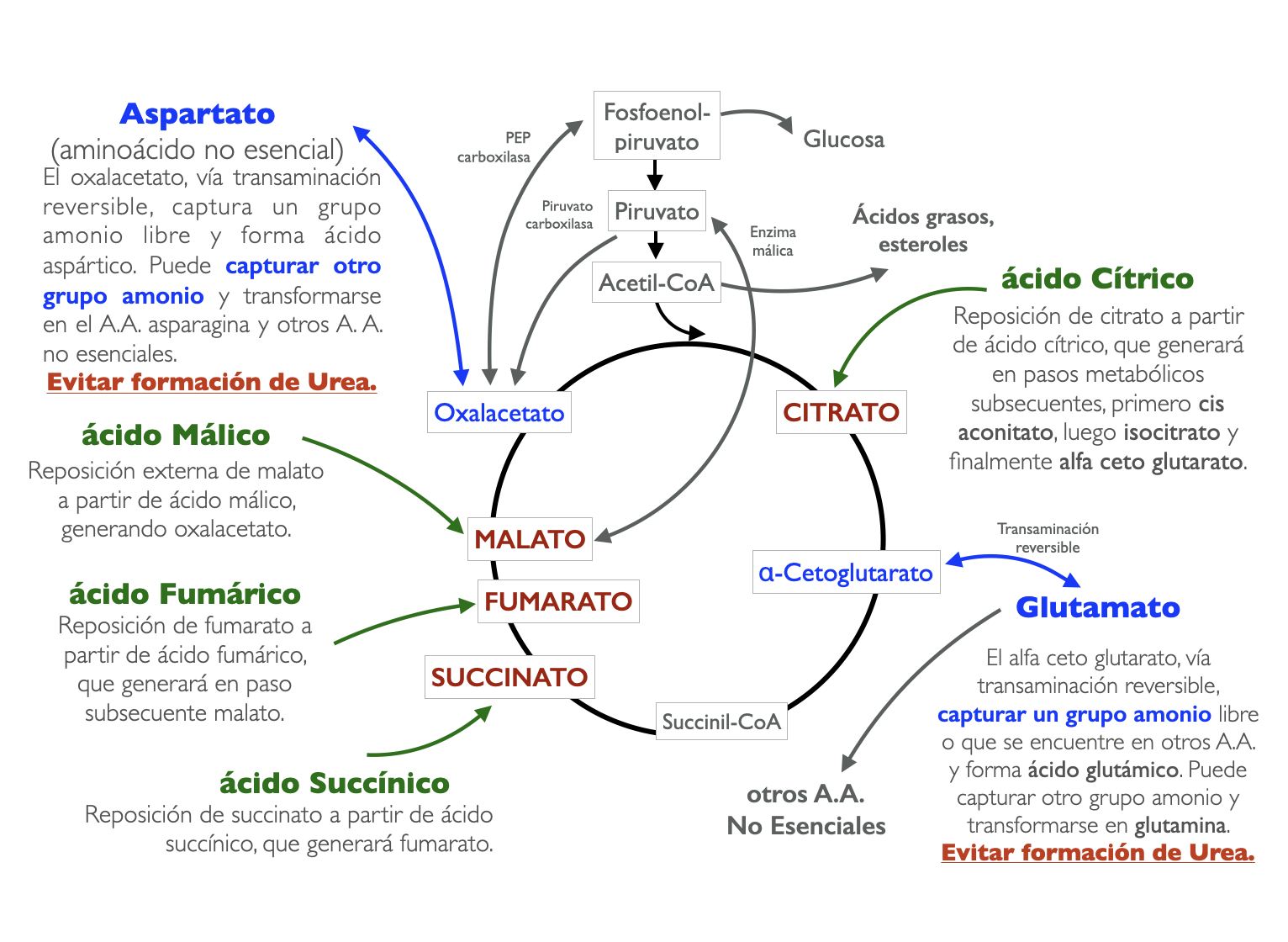
Los metabolitos intermediarios del Ciclo de Krebs de la formulación estudiada son: ácido cítrico, ácido succínico, ácido fumárico y ácido málico, en combinación con bicarbonato de sodio y quelantes cálcicos de fósforo: carbonato de calcio y lactato de calcio. Dichos ácidos en el ambiente acuoso del organismo se disocian en sus correspondientes aniones e ingresan a nivel celular, más específicamente a nivel mitocondrial (el Ciclo de Krebs se realiza a nivel mitocondrial), en donde participan en la vía anapletórica (de reposición, de relleno de intermediarios metabólicos), generando dos moléculas con función química ceto en el carbono alfa: oxalacetato de 4 carbonos y alfacetoglutarato de 5 carbonos. Estos dos intermediarios metabólicos, por reacciones de transaminación capturan grupos NH3 (amoniaco) con lo que generan la formación de aminoácidos no esenciales. Así, el oxalacetato genera ácido aspártico, asparagina y otros aminoácidos relacionados; el alfacetoglutarato genera ácido glutámico, glutamina y otros aminoácidos emparentados, en total 10 aminoácidos no esenciales se generan por estas reacciones, con lo que se reutiliza el amonio sérico proveniente del catabolismo de los aminoácidos y otras moléculas con grupos NH2 y NH3, evitando, que el amonio ingrese al Ciclo de la Urea para su posterior eliminación, con lo que mejora, por la neoformación de aminoácidos no esenciales, el estado nutricional del paciente. Es por este mecanismo que disminuye la urea sérica y simultáneamente se contiene la acidosis metabólica por el bicarbonato de sodio además del control de la hiperfosfatemia por la quelación del fósforo a nivel intestinal ejercida por el carbonato de calcio y lactato de calcio. En cuanto a la disminución de la creatinina sérica y por consecuencia el aumento de la TFGe, se tiene la hipótesis de ser por efectos pleiotrópicos, al ejercer la formulación múltiples beneficios simultáneos: disminución de urea, disminución de fósforo, mejoría del estado nutricional y control de la acidosis metabólica.
Los resultados de estos dos estudios permiten al clínico considerar incluir como terapia estándar en un paciente con ERC en el que se desea salvaguardar la función renal, a los metabolitos intermediarios del Ciclo de Krebs, dado que existe sustento científico documental y clínico que respalda, que presenta evidencias, para de esta manera postergar en la medida de lo posible el uso de Terapias Renales de Reemplazo como una de las últimas medidas de manejo de estos pacientes. Mención especial merece comentar, el uso de esta formulación en los pacientes que, por su convicción, no aceptan terapias renales de reemplazo y el médico clínico opta por un tratamiento conservador paliativo.
LA CLAVE ESTÁ EN LA ANAPLEROSIS
El término anaplerosis fue acuñado por primera vez por Kornberg en el año 1966. Describió el mecanismo como vías para recuperar un ciclo metabólico. En condiciones de oxidación catabólica, las concentraciones de intermediarios del Ciclo de Krebs son muy bajas (10−5−10−4 mol/L). No se eliminan ni se construyen intermediarios del ciclo. Sin embargo, además de la oxidación del sustrato, los intermediarios del Ciclo de Krebs actúan como puntos de partida de las vías anabólicas. Los intermediarios sirven para la biosíntesis de ácidos grasos (citrato), la biosíntesis del hemo (succinil-CoA), la gluconeogénesis (oxaloacetato) y la biosíntesis de aminoácidos no esenciales (α-cetoglutarato y oxaloacetato) [ver Ref. 4].
Se tiene que dimensionar la anaplerosis como algo sistémico que ocurre en cada célula del cuerpo y no verlo de manera aislada. Cuando existe enfermedad, está evidenciado que se depletan estos sustratos o intermediarios del Ciclo de Krebs. En base a las rutas metabólicas del ciclo, podemos inferir, y así lo dice la literatura, que al reponer los intermediarios esperar lo siguiente:
-
mejoría del HEM por la succinil-CoA / fumarato
-
síntesis de aminoácidos no esenciales: alanina, arginina, aspargina, ácido aspártico, cistenina, ácido glutámico, glicina, prolina, serina, tirosina, histidina.
Y con esto, inferir mejoría del estado nutricional y disminución en la tasa de formación de amonio y por consiguiente, urea. Siempre visualizar el ciclo del amonio en un conjunto, no por separado. Si baja el amonio, baja la urea. El ciclo de la urea tiene lugar principalmente en el hígado y comprende la síntesis de urea a partir de amonio.
METABOLÓMICA
Análisis en metabolómica y de la expresión de genes revelan una regulación a la baja de los intermediarios del Ciclo de Krebs en personas con ERC. Más allá, el análisis de las rutas metabólicas muestran que este ciclo fue el más afectado con una reducción en los niveles de citrato y succinato del 40-68%. Este hallazgo apoya la hipótesis de que varias patologías tienen como trasfondo una función inadecuada de las mitocondrias.
La actividad disminuida del Ciclo de Krebs puede ser debida a una reducción en la biogénesis de mitocondrias, en una reducción de la expresión de los genes que codifican las enzimas del ciclo o una reducción de los substratos disponibles del mismo ciclo.
En conclusión, se observó un patrón de metabolitos significativamente alterados, en conjunto con una actividad reducida del ciclo, reducción de la oxidación de ácido graso y un incremento del metabolismo de cuerpos cetónicos [ver Ref. 5].
Ciertos aminoácidos e intermediarios del Ciclo de Krebs también contribuyen a la respuesta miocárdica citoprotectora a la isquemia. Estudios han reportado que el miocardio hipóxico isquémico convierte el aspartato y el glutamato a succinato vía el Ciclo de Krebs, generando ATP y GTP. El fumarato estabiliza e incrementa la proteína Nrf2 [ver Ref. 6].
En condiciones naturales, los principales substratos de la vía anapletórica del Ciclo de Krebs son el piruvato, glutamato/glutamina y precursores de la propionil coenzima A (ácidos grasos de cadena larga, aminoácidos específicos y cuerpos cetónicos de 5 carbonos).
Existe buena evidencia de que un número de condiciones patológicas pudieran beneficiarse de la reposición de los substratos de la vía anapletórica. Condiciones asociadas a la reperfusión de tejidos (infartos miocárdicos, embolias, trasplante de órganos) están asociados con daño a las membranas celulares y una posible disminución en la cantidad de ciertos intermediarios del Ciclo de Krebs [ver Ref. 7].
OTROS BENEFICIOS ASOCIADOS A LA
DISMINUCIÓN DE UREA SÉRICA
La urea puede ejercer toxicidad directa en varios tejidos, como el epitelio intestinal, las paredes vasculares, las células β pancreáticas y los adipocitos, y toxicidad indirecta a través de la carbamilación [ver Ref. 8,9].
La urea se disocia lentamente en cianato, que se convierte rápidamente en isocianato. […] Se ha reconocido que la carbamilación es una modificación espontánea postraduccional de aminoácidos y proteínas mediada por el cianato, que conduce a alteraciones bioquímicas [ver Ref. 10].
La urea induce la producción de especies reactivas del oxígeno (ROS) en los adipocitos, lo que conduce a la resistencia a la insulina [ver Ref. 11].
Los defectos secretores de insulina asociados con la ERC surgen de niveles circulantes elevados de urea que aumentan la proteína de islote O-GlcNacilación y deterioran la glucólisis [ver Ref. 12].
Las proteínas carbamiladas están asociadas con mortalidad general y mortalidad cardiovascular en pacientes con ERC Terminal [ver Ref. 13,14,15].
Referencias
-
Hernández-Miramontes JA, Méndez-Durán A, Hernández-Villanueva JA. Tricarboxylic cycle intermediates in combination with calcium phosphate chelators and sodium bicarbonate increase eGFR in patients with stages 3b, 4 and 5 CKD: a retrospective observational study. Rev Colomb Nefrol. 2024;11(2):1-18. https://revistanefrologia.org/index.php/rcn/article/view/778/1115
-
de Brito-Ashurst I, Varagunam M, Raftery MJ, Yaqoob MM. Bicarbonate supplementation slows progression of CKD and improves nutritional status. J Am Soc Nephrol. 2009;20(9):2075-2084. doi:10.1681/ASN.2008111205
-
Hernández-Miramontes JA, Hernández-Villanueva JA, Pacifuentes-Orozco A, Méndez-Durán A. Ácidos carboxílicos en combinación con quelantes cálcicos de fósforo y bicarbonato de sodio para el tratamiento de la uremia e hiperfosfatemia en pacientes con ERC estadios 3, 4 y 5. Gac Med Bilbao. 2019;116(3):104-109. https://gacetamedicabilbao.eus/index.php/gacetamedicabilbao/article/view/707
-
Werner C, Doenst T, Schwarzer M. Metabolic Pathways and Cycles. The Scientist's Guide to Cardiac Metabolism. 2016;39-55.
-
Hallan S, Afkarian M, Zelnick LR, Kestenbaum B, Sharma S, Saito R, Darshi M, Barding GA, Raftery D, Ju W, Kretzler M, Sharma K, & De Boer IH. Metabolomics and gene expression analysis reveal down-regulation of the citric acid (TCA) cycle in non-diabetic CKD patients. EBioMedicine. 2017;26: 68-77. https://doi.org/10.1016/j.ebiom.2017.10.027
-
Ashrafian H, Czibik G, Bellahcene M, Aksentijevic D, Smith A C, Mitchell SJ, Dodd MS, Kirwan J, Byrne J, Ludwig C, Isackson H, Yavari A, Støttrup NB, Contractor H, Cahill TJ, Sahgal N, Ball DR, Birkler RID, Hargreaves IP, Watkins H. Fumarate is cardioprotective via activation of the NRF2 antioxidant pathway. Cell Metabolism. 2012;15(3):361-371. https://doi.org/10.1016/j.cmet.2012.01.017
-
Brunengraber H, Roe CR. Anaplerotic molecules: current and future. Journal of Inherited Metabolic Disease. 2005;29(2-3):327-331. https://doi.org/10.1007/s10545-006-0320-1
-
Lau WL, Vaziri ND. Urea, a true uremic toxin: the empire strikes back. Clin Sci (Lond). 2017;131:3–12.
-
Vanholder R, Gryp T, Glorieux G. Urea and chronic kidney disease: the comeback of the century?. Nephrol Dial Transplant. 2018;33:4–12.
-
Seki M, et al. Blood urea nitrogen is independently associated with renal outcomes in Japanese patients with stage 3–5 chronic kidney disease: a prospective observational study. BMC Nephrology. 2019;20:115.
-
D’Apolito M, Du X, Zong H, Catucci A, Maiuri L, Trivisano T, et al. Urea-induced ROS generation causes insulin resistance in mice with chronic renal failure. J Clin Invest. 2010;120:203–13.
-
Koppe, L. et al. Urea impairs β cell glycolysis and insulin secretion in chronic kidney disease. The Journal of Clinical Investigation. 2016;126(9):3598-3612.
-
Berg AH, Drechsler C, Wenger J, Buccafusca R, Hod T, Kalim S, et al. Carbamylation of serum albumin as a risk factor for mortality in patients with kidney failure. Sci Transl Med. 2013;5:175ra29.
-
Drechsler C, Kalim S, Wenger JB, et al. Protein carbamylation is associated with heart failure and mortality in diabetic patients with ESRD. Kidney Int. 2015;87:1201–8.
-
Koeth RA, Kalantar-Zadeh K, Wang Z, Fu X, Tang WH, Hazen SL. Protein carbamylation predicts mortality in ESRD. J Am Soc Nephrol. 2013;24:853–61.